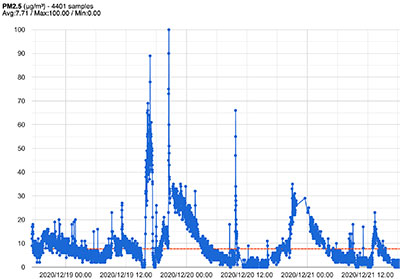
L’axe 1 associe des études biocliniques et épidémiologiques de type EXPOSOME sur cohortes pour identifier les facteurs environnementaux et individuels de progression (expositions, comorbidités, facteurs socio-économiques), et des études de modélisation du processus pulmonaire fibrosant à partir d’images tomodensitométriques et de données physiologiques. Les principales réalisations et les projets en cours sont les suivants :
 |
 |
 |

Hypoxie & Poumon
Bioingénierie des voies aériennes
Hypoxie & Poumon
Pneumopathies interstitielles diffuses.Recherche
Axe 2. Impact du microenvironnement dans les modèles expérimentaux de Pneumopathies Interstitielles Diffuses (responsible scientifique : Carole Planès)
L’axe 2 est le pendant expérimental de l’axe 1. Il associe des travaux translationnels sur prélèvements de patients, des approches in vitro sur cultures primaires et in vivo sur modèles précliniques murins de fibrose/granulomatose pulmonaires pour étudier le rôle du microenvironnement (hypoxie, atmosphères polluées complexes) et les processus cellulaires/moléculaires impliqués dans le processus fibrosant. Les principales réalisations et les travaux en cours sont les suivants :
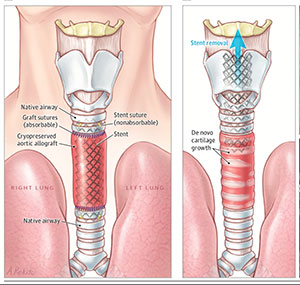
Axe 3. Réparation / Régénération / Remplacement des tissus pulmonaires (responsables scientifiques : Emmanuel Martinod et Valérie Besnard)
L’axe 3 étudie d’une part les facteurs favorisant la réparation/régénération alvéolaire après lésion, et d’autre part les modalités de remplacement des grosses voies aériennes. Les approches utilisées combinent chirurgie innovante et ingénierie tissulaire in vitro et in vivo dans des modèles animaux de remplacement trachéal ou d’agression alvéolaires. Les principales réalisations et les travaux en cours sont les suivants :